Sadržaj
Postotak mase određuje postotak svakog elementa koji tvori kemijski spoj. Da biste pronašli ovu vrijednost, trebat će vam molarna masa složenih elemenata u gramima / molovima ili broj grama upotrijebljenih za stvaranje otopine. Postotak mase može se izračunati na jednostavan način pomoću osnovne formule koja dijeli masu elementa (ili otopljene tvari) s masom spoja (ili otopine).
Koraci
Metoda 1 od 2: Pronalaženje postotka mase s danim masama
- Definirajte jednadžbu postotka mase spoja. Osnovna formula za spoj je: postotak mase = () x 100. Rezultat morate pomnožiti sa 100 na kraju da biste vrijednosti izrazili u postocima.
- Masa kemijskog spoja koji vas zanima je masa dana u zadatku. Ako ova vrijednost nije navedena, pogledajte sljedeću Metodu i naučite kako pronaći postotak mase kada masa nije navedena.
- Ukupna masa spoja izračunava se zbrajanjem masa svih elemenata koji se koriste za stvaranje spoja ili otopine.
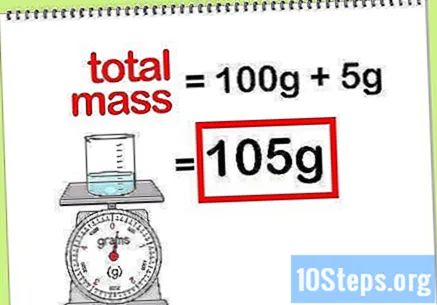
Izračunajte ukupnu masu spoja. Kad znate vrijednost mase svih dodanih elemenata ili spojeva, jednostavno ih trebate zbrojiti za izračun mase spoja ili konačne otopine. Ova vrijednost bit će nazivnik u izračunu postotka mase.- Na primjer: Koliki je postotak mase 5 g natrijeva hidroksida otopljenog u 100 g vode?
- Ukupna masa spoja je količina natrijevog peroksida plus količina vode: 100 g + 5 g, ukupne mase 105 g.

Odredite masu dotične kemikalije. Kada trebate pronaći postotna masa, problem želi da pronađete masu određenog elementa (predmetni element) kao postotak od ukupne mase svih elemenata. Zabilježite masu dotičnog elementa. Ova vrijednost bit će brojnik u izračunu postotka mase.- Na primjer, masa elementa je 5 g natrijevog hidroksida.
- Zamijenite varijable u formuli postotka mase. Nakon utvrđivanja vrijednosti za svaku varijablu, zamijenite ih u jednadžbi.
- Na primjer: postotak mase = () x 100 = () x 100.

Izračunajte postotak mase. Sada kada je jednadžba formirana, samo je riješite kako biste izračunali postotak mase. Podijelite masu elementa s ukupnom masom spoja i pomnožite sa 100. Rezultat će biti postotak mase kemijskog elementa.- Na primjer: () x 100 = 0,04761 x 100 = 4,751%. Dakle, postotak mase 5 g natrijeva hidroksida otopljenog u 100 g vode je 4,751%.
Metoda 2 od 2: Pronalaženje postotka mase s ne navedenim masama
- Definirajte jednadžbu za postotak mase spoja. Osnovna formula za postotak mase spoja je: postotak mase = () x 100. Rezultat morate pomnožiti sa 100 na kraju da biste vrijednosti izrazili u postocima.
- Kad ne znate vrijednosti mase, pomoću molarne mase možete pronaći postotak mase elementa spoja.
- Na primjer: Koliki je postotak mase vodika u molekuli vode?.
Napiši kemijska formula. Ako kemijske formule za svaki spoj nisu navedene, morat ćete ih zapisati. U suprotnom, preskočite na korak "Pronađi masu svakog elementa".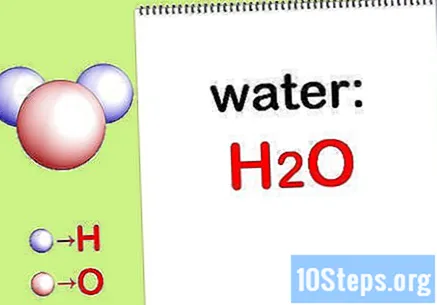
- Na primjer, napiši kemijsku formulu za vodu: H2THE.
Pronađite masu svakog elementa u spoju. Potražite molekularnu težinu svakog elementa kemijskih formula pozivajući se na periodni sustav. Općenito, masa elementa može se naći ispod simbola kemijskog elementa. Zabilježite mase svakog elementa spoja.
- Na primjer, molekulska masa kisika je 15,9994, a molekula vodika 1,0079.
Množimo mase molarnim omjerom. Utvrdite koliko je madeža pojedinog elementa u kemijskom spoju. Broj madeža daje se pretplaćenim brojem spoja. Pomnožite molekularnu masu svakog elementa s molarnim omjerom.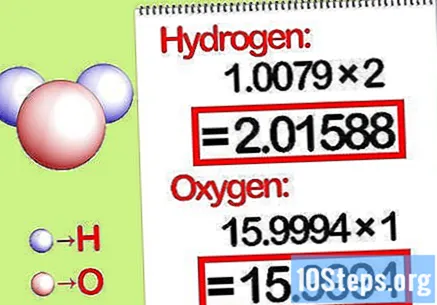
- Na primjer, molarni omjer vodika i kisika u vodi je 2: 1. Stoga pomnožite molekulsku težinu vodika s dva (1,00794 X 2 = 2,01588) i ostavite molekularnu težinu kisika kakva jest (15,9994).
Izračunajte ukupnu masu spoja. Dodajte ukupnu masu svih elemenata spoja. Koristeći mase izračunate molarnim omjerom, moguće je izračunati ukupnu masu spoja. Taj će broj biti nazivnik jednadžbe postotka mase.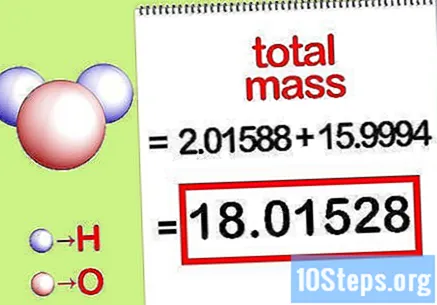
- Na primjer, dodajte 2,01588 g / mol (masa dva mola atoma vodika) s 15,9994 g / mol (masa jednog mola atoma kisika) i dobijte 18,01528 g / mol.
Utvrdite masu dotičnog elementa. Kada trebate pronaći postotna masa, problem želi da pronađete masu određenog elementa u spoju kao postotak ukupne mase svih elemenata. Utvrdite masu dotičnog elementa i zapišite ga. To je vrijednost mase izračunata pomoću molarnog omjera. Ova vrijednost je brojnik jednadžbe postotka mase.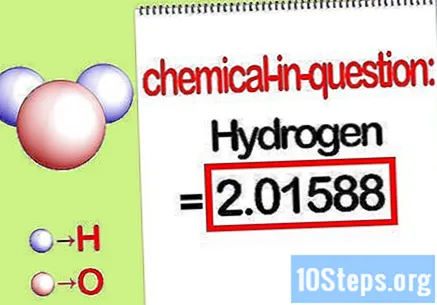
- Na primjer, masa vodika spoja je 2,01588 g / mol (masa dva mola atoma vodika).
- Zamijenite varijable u formuli postotka mase. Nakon određivanja vrijednosti za svaku varijablu, zamijenite ih u jednadžbi definiranoj u prvom koraku: postotna masa = () x 100.
- Na primjer: postotak mase = () x 100 = () x 100.
Izračunajte postotak mase. Sada kada je jednadžba formirana, samo je riješite kako biste izračunali postotak mase. Podijelite masu elementa s ukupnom masom spoja i pomnožite sa 100. Rezultat će biti postotak mase kemijskog elementa.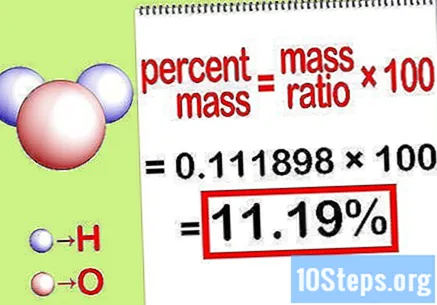
- Na primjer, postotna masa = () x 100 = 0,111189 x 100 = 11,18%. Dakle, postotak mase atoma vodika u molekuli vode iznosi 11,18%.