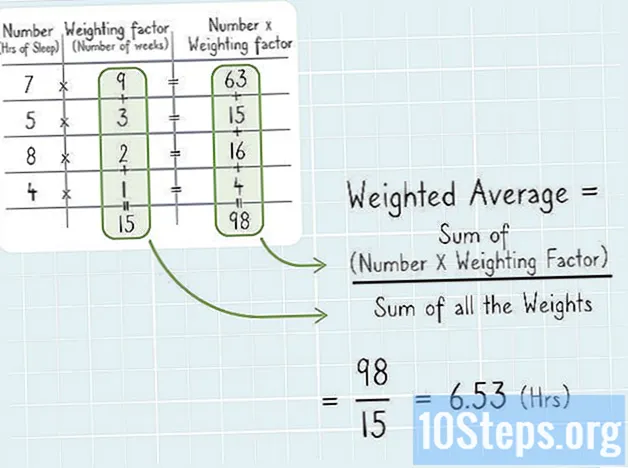
Sadržaj
Ostali odjeljciVodik je najlakši element i ima mnoge industrijske namjene, uključujući stvaranje hidrogeniziranih masti za upotrebu u kuhinji i proizvodnju ugljikovodika iz ugljena. To je važan dio molekula vode i može se odvojiti pomoću male količine električne energije. Također možete proizvoditi plinoviti vodik koristeći neke aktivne metale i jake kiseline. Obje su metode relativno jednostavne i omogućit će vam prikupljanje plinovitog vodika.
Koraci
Metoda 1 od 2: Korištenje istiskivanja vode s aktivnim metalima
Skupite potrebne materijale. Za prikupljanje vodika reakcijom miješanja jake kiseline s aktivnim metalom trebat će vam: Erlenmeyerova tikvica, gumeni čep, plastične cijevi, destilirana voda, epruvete, velika posuda, 3 molarna solna kiselina (HCl) i magnezijeve ili cinkove pelete.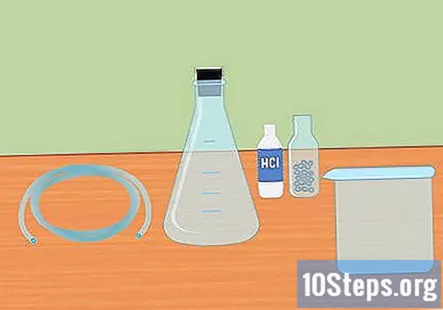
- Erlenmeyerova tikvica je staklena tikvica koja ima konusno dno i cilindrični vrat.
- Gumeni čep je za vrh tikvice i u sredini mora imati otvor za prolazak cijevi.
- Za ovaj će eksperiment raditi magnezij ili cink, ne trebaju vam oboje.
- Neke od ovih potrepština možda će trebati kupiti putem interneta ili u laboratorijskoj trgovini.

Nosite odgovarajuću zaštitnu opremu. Kada radite s jakom kiselinom kao što je klorovodična kiselina, želite biti sigurni da poduzimate odgovarajuće sigurnosne mjere. Nošenje laboratorijskog kaputa, rukavica, zatvorenih cipela i zaštite očiju je neophodno.- Naočale se trebaju omotati oko strana očiju kako bi ih zaštitile od prskanja.
- Nosite rukavice koje pravilno pristaju kako biste održali dobru spretnost ruku i prstiju.
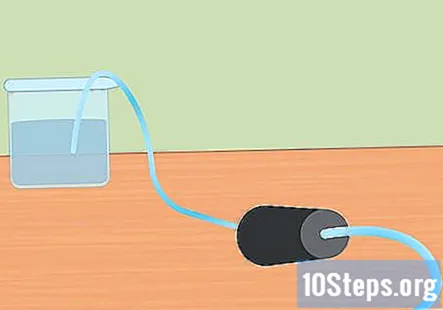
Pripremite eksperimentalnu postavku. Umetnite jedan kraj cijevi u rupu gumenog čepa. Želite da cijevi prolaze do kraja kroz gumeni čep i lagano strše s kraja. Napunite veliku posudu vodom i stavite slobodni kraj cijevi u vodu. Kad eksperiment započne, gumeni čep stavit ćete u Erlenmeyerovu tikvicu.- Ostavite ove komade sa strane dok ne budete spremni za upotrebu.
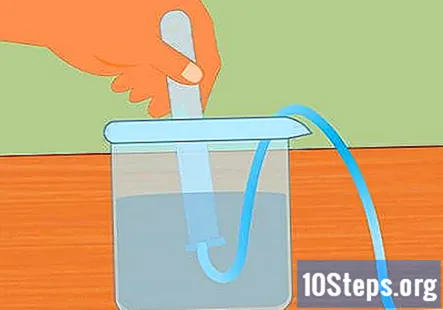
Potopite epruvetu u vodu. Uzmite barem jednu epruvetu (možete ih koristiti više ako želite prikupiti više vodika) i potopite je u vodu. Nagnite cijev tako da svi mjehurići zraka mogu pobjeći. Stavite cijev na vrh potopljene cijevi pričvršćene za gumeni čep na suprotnom kraju.- Prije početka započetog rada neophodno je ukloniti sve mjehuriće zraka iz cijevi. Ako nisu, plin prikupljen u cijevi bit će više nego samo vodik.
U Erlenmeyerovu tikvicu dodajte solnu kiselinu. Dodajte dovoljno klorovodične kiseline da se tikvica napuni otprilike do pola. Trebalo bi biti dovoljno oko 100 ml. Prije dodavanja kiseline provjerite je li tikvica čista i suha. Nosite gumene rukavice i budite oprezni prilikom punjenja tikvice.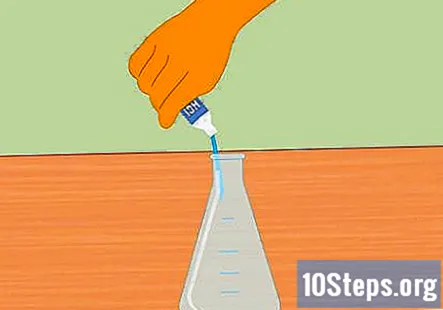
- Pazite da u kiselinu ne prolijete vodu. Voda dodana kiselini može dovesti do eksplozije i ozljede.
Započnite kemijsku reakciju dodavanjem metalnih peleta u HCl. Klorovodičnoj kiselini u tikvici dodajte šaku peleta cinka ili magnezija. Točan iznos koji unesete nije važan, ali mala šačica trebala bi biti dovoljna za pokretanje reakcije.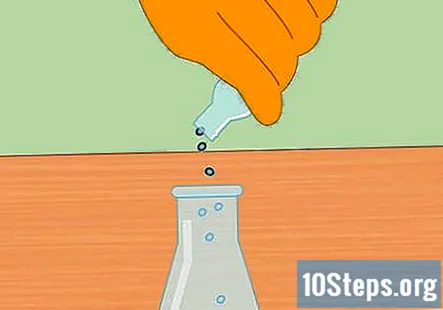
- Nakon dodavanja peleta, stavite čep u tikvicu tako da je sustav sada zatvoren.
Sakupite vodik u potopljenu epruvetu. Kako metal reagira s kiselinom, stvara se plinoviti vodik. Taj vodik putuje do vrha tikvice, kroz cijev i u epruvetu uronjenu u vodu. Plin će istisnuti vodu i trebali biste vidjeti mjehurić na vrhu epruvete.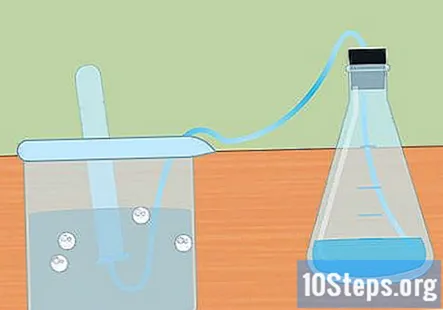
- Kad se epruveta napuni vodikom, drugu epruvetu potopite vodom i stavite preko cijevi. Možete prikupiti onoliko vodika koliko nastane vašom reakcijom.
- Držite epruvete okrenute prema dolje kako biste spriječili istjecanje plinovitog vodika u zrak.
Potvrdite da je plin vodik. Da biste potvrdili da je plin vodik, možete napraviti ono što se naziva test udlage. Zapalite šibicu i držite je ispod cijevi. Čut ćete zvuk "pucanja" ili škripanja, što znači da je prisutan vodik.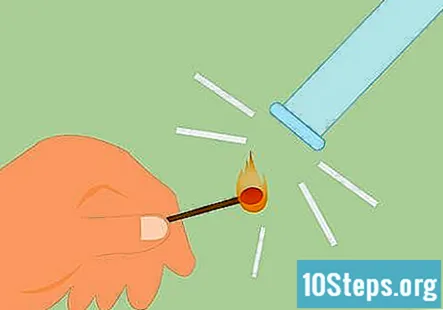
Metoda 2 od 2: Korištenje elektrolize
Skupite potrebne materijale. U ovom ćete eksperimentu električnom energijom odvajati vodik i kisik od molekula vode. Za prikupljanje plinovitog vodika elektrolizom trebat će vam 9-voltna baterija, olovka, dvije epruvete, plastična posuda, voda, soda bikarbona, dvije velike gumene trake (nije obavezno) i kopča za bateriju sa stezaljkama na kraju.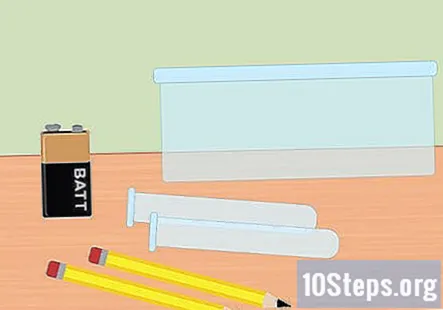
- Da bi ovo uspjelo, olovka mora imati grafit. Olovka broj 2 je savršena. Za to će raditi i dva mala komada grafita.
- Dovoljan je mali spremnik ili zdjela za skladištenje hrane.
- Pazite da kopča za bateriju može stati na 9-voltnu bateriju i da na kraju ima crvenu i crnu žicu s aligatorskim stezaljkama. Te će se stezaljke koristiti za spajanje vašeg sustava na bateriju.
Izvadite gumicu iz olovke i slomite olovku na pola. Potrebna su vam dva komada grafita, jedan za pozitivni kraj baterije i za negativni kraj baterije. Oštrite oba kraja svakog dijela olovke do točke. Provjerite je li grafit dobro izložen.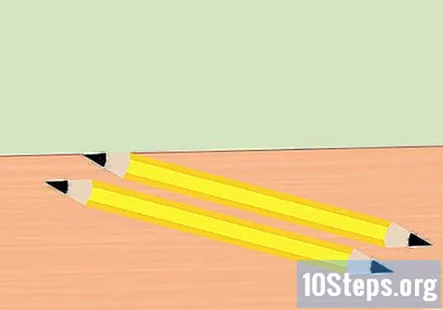
- Ovaj korak možete preskočiti ako već imate dva komada čistog grafita.
Omotajte 2 gumene vrpce oko posude u obliku slova X. Ovaj korak nije obavezan, ali je jednostavan način da epruvete držite na mjestu dok eksperiment traje. Razvucite jednu gumenu traku preko posude, a drugu preko nje tako da prelazi preko prve, tvoreći X.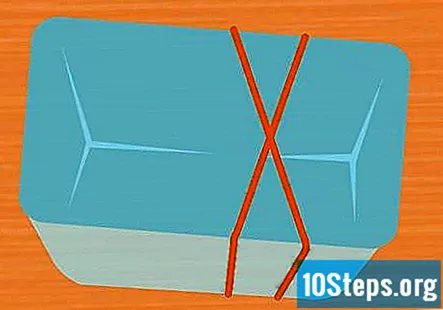
- Ako ne koristite gumene trake, pobrinite se da epruvete učvrstite trakom ili vrpcom tako da tijekom eksperimenta ostanu naopake.
Napravite otopinu sode bikarbone i vode. Otapanje sode bikarbone u vodi pomoći će u provođenju električne energije u sustavu. Točna količina dodane sode bikarbone nije važna, ali trebala bi biti dovoljna oko 1 žličica na 1 šalicu vode. Miješajte dok se potpuno ne otopi.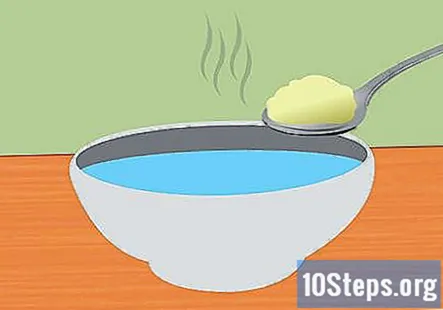
- Koristite toplu vodu da ubrzate otapanje sode bikarbone.
Napunite plastičnu posudu i epruvete otopinom sode bikarbone. Spremnik mora biti dovoljno velik da sadrži obje epruvete. Dodajte dovoljno otopine da napunite spremnik otprilike tri četvrtine. Potopite epruvete u otopinu posude i preokrenite ih naopako. Stavite svaku cijev u križ gumene trake X kako biste je držali na mjestu.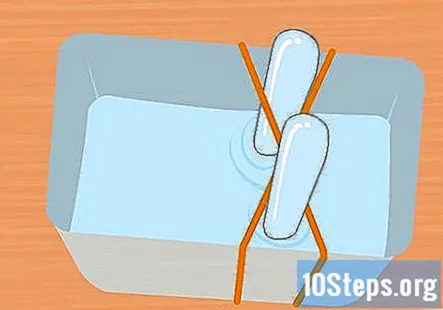
- Vrlo je važno da su obje epruvete potpuno prepune vode i da ne ostanu mjehurići zraka.
Na grafit pričvrstite držače aligatora. Izvadite jednu stezaljku s kopče baterije i pričvrstite je na kraj jedne od olovaka. Pazite da dodiruje što više grafita. Učinite isto s preostalom pločicom za aligator i olovkom.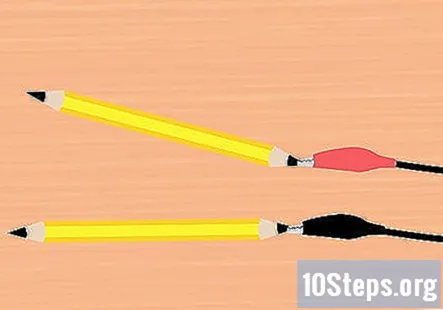
- Na crvenu stezaljku treba pričvrstiti jednu olovku, a na crnu stezaljku.
Gurnite nezategnuti kraj olovke u epruvetu. Držite epruvetu potpuno potopljenom, lagano je nagnite tako da netaknuti kraj olovke možete gurnuti u epruvetu. Ponovite ovaj postupak s drugom olovkom i drugom epruvetom.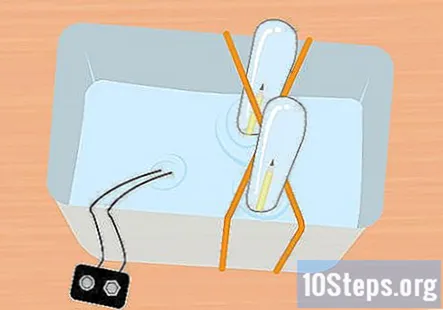
- U ovom trenutku sve bi trebalo biti pod vodom i unutar svake epruvete trebao bi biti jedan komad olovke.
- Držite kraj kopče baterije koja je pričvršćena na bateriju izvan vode.
Pričvrstite kopču za bateriju na 9-voltnu bateriju. Uz sve postavljeno, sada ste spremni primijeniti električnu energiju koju daje 9-voltna baterija. Kraj kopče baterije trebao bi viriti iz spremnika, tako da jednostavno zakvačite bateriju na mjesto. Nakon što je baterija pričvršćena, trebali biste primijetiti kako se mjehurići dižu s kraja grafita i plutaju na vrhu svake epruvete.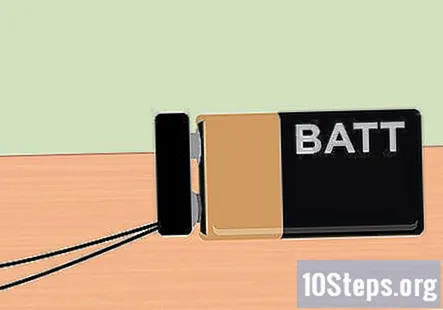
- Ako ne vidite proizvedene mjehuriće, provjerite jesu li aligatorske stezaljke čvrsto pričvršćene na grafit olovke. Također provjerite je li baterija potpuno napunjena.
- Epruveta s negativnom žicom pričvršćenom na olovku proizvodit će vodik, dok će epruveta pričvršćena na pozitivnu žicu baterije proizvoditi kisik.
Skupljajte vodik i kisik u dvije epruvete sve dok u svakoj epruveti nemate nekoliko centimetara plina. Zapamtite, cijev spojena na negativni kraj baterije imat će vodik, a kisik će biti u cijevi spojenoj na pozitivni kraj. Izvadite epruvete iz staklenke, jednu po jednu. Držite ih naopako i pustite da voda iscuri. Plin u cijevima ostat će iako ga ne možete vidjeti.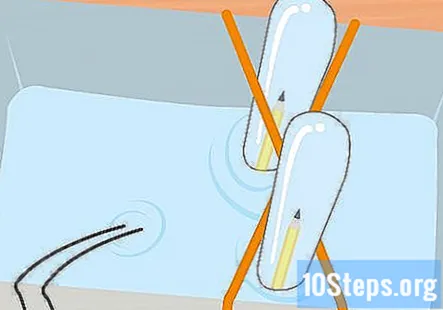
Ispitajte prisutnost vodika. Možete ispitati prisutnost vodika udarajući šibicu i pridržavajući plamen do plina. Ispunit će vrlo jasan zvuk "škripavog pop" ako je vodik. Umjesto šibice možete upotrijebiti i upaljenu svijeću.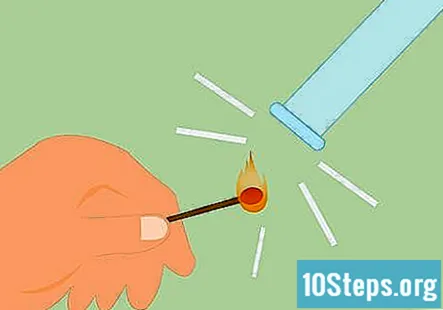
- Da biste testirali kisik u epruveti koja je bila spojena na pozitivnu stranu izvora napajanja, ispuhnite upaljenu šibicu (ili svijeću) i stavite još uvijek užareni kraj ispod epruvete. Ako se svijeća ponovo upali, prisutan je kisik.
Pitanja i odgovori zajednice
Trebam li dvije epruvete ako želim sakupljati samo vodik?

Znanstvenica za okoliš Bess Ruff studentica je geografije na Državnom sveučilištu Florida. Magistrirala je znanost o okolišu i upravljanje na Sveučilištu u Kaliforniji u Santa Barbari 2016. Provela je istraživačke radove na projektima prostornog planiranja mora na Karibima i pružala je istraživačku potporu kao diplomirani suradnik za Održivu ribarstvo.

Koliko se vodika može prikupiti iz ovog jednostavnog pokusa elektrolize? A koliki bi bio pritisak vodikovog plina?
Ovisi. Brzina reakcije (cijepanje vode) temelji se na pojačalima baterije i vremenu preostalom za reakciju. Tipično bi vodik bio pod pritiskom na razini mora, osim ako eksperiment ne radite u stvarno vrućem ili hladnom okruženju.
Zašto se vodik skuplja u negativnoj cijevi
Zbog načina na koji molekule vode dijele elektrone, atomi vodika su pozitivno nabijeni, a atomi kisika negativno nabijeni. Pri izvlačenju plinova, pozitivno nabijeni vodik privući će se u negativnu cijev, dok će negativno nabijeni kisik privući pozitivna cijev.
Zašto mi plin nije izlazio iz cijevi za sakupljanje plina?
To je vodik, plin koji je lakši od svih ostalih, uključujući helij, što znači da će ostati u epruveti sve dok je zatvoreni kraj epruvete na vrhu jer ga ostali plinovi istiskuju. Razlog zbog kojeg koristimo helij umjesto vodika je taj što nije zapaljiv. To je zbog činjenice da je to plemeniti plin (ima punu valentnu ljusku od 8 elektrona) i stoga nije reaktivan.
Bi li plin bio vrlo zapaljiv?
Da. Pogledajte katastrofu u Hindenburgu na YouTubeu. Cepelini su koristili vodik jer je najlakši plin i prilično ga je lako dobiti. Također je razlog zašto neki proizvođači automobila rade na automobilima na vodik.
je li to tekući oblik vodika?
Ne - vodik u ovom eksperimentu bit će plinovit
Kako mogu ukapliti vodik? Odgovor
Upozorenja
- Budite oprezni s čistim vodikom. Vrlo je eksplozivan kada se pomiješa sa zrakom.
- Obavezno uklonite sav ostali zrak iz opreme u kojoj skupljate vodik.